Vous avez une russule inconnue ?
Vous avez une russule inconnue ?Sans une estimation de la couleur (ou teinte) de la sporée, vous aurez du mal à l’identifier, car la plupart des clés se basent sur cette information.
Ce tutoriel contient des vidéos qui se lancent en cliquant sur les images comportant un petit triangle ; la vidéo est terminée quand apparaît sa ligne bleue de progression, toute remplie. Pour revenir à la suite du tutoriel, cliquez sur la flèche de retour en arrière de votre navigateur.
 Note :
Note :
La vidéo a été prise le lendemain de la récolte, c’est pourquoi la russule est un peu défraichie.
Note 1 :
En 12 heures la quantité de spores est parfois insuffisante et après 36 heures, les larves commencent à quitter le chapeau et à tomber sur la sporée, ce qui la détériore.
Note 2 :
Veillez à ce que le chapeau ne repose pas trop à plat sur le verre, de manière à laisser un peu d’aération sous le chapeau, la formation de buée, apparaissant souvent sous les grosses russules serait fatale pour la sporée.
Mettre la vitre verticalement et éliminer les particules étrangères :
Note :
Il n’y a aucun risque que les spores tombent, elles adhérent fortement, par capillarité.
Note :
La sporée rassemblée en tas adhère mal au verre,
manipuler avec précaution.
Écraser la sporée entre deux lames de microscope :
Note 1 :
Bien rassembler au préalable la sporée en un tas cubique.La sporée reste collée sur une des lames, en bas ou en haut, si elle se déchire, recommencer.
Note 2 :
Le résultat final doit être une sporée bien plate, opaque, et en un seul morceau, de 2 à 10 mm.
La sporée reste collée sur une des lames, en bas ou en haut,si elle se déchire, recommencer.
Préparer la prise de la photo sur fond noir.
Placer le bristol portant la référence de blanc par-dessus.
Brancher la LED verte qui va éclairer la scène. Elle peut-être tenue à la main au dessus de la sporée.
Note 1 :
L’usage et la description
du bristol avec ses
pastilles blanches est décrit ici..
Note 2 :
Pour une meilleure reproductibilité, la LED est placée verticalement au dessus le la sporée et l’axe de la photo est à 30° de la verticale.
Se placer dans une pièce noire pour ne pas avoir de lumière parasite.
Éteindre toutes les lumières autres que celle de la LED verte.
Note :
Régler votre appareil photo pour qu’il enregistre la photo en format « Raw ».
Les photos en format .jpeg ne conviennent pas, car elle ne respectent pas les contrastes de la scène.
Voir ici pour plus d’explication sur la raison de ce choix.
Même scène que précédemment vue par l’appareil photo.
Voici la photo de la sporée (en format Raw ) ainsi que les pastilles blanches de référence.
L’exposition typique est 1/5 seconde à f/2, avec la LED à 30 cm, ce qui nécessite un pied ou un moyen quelconque pour fixer l’appareil photo.
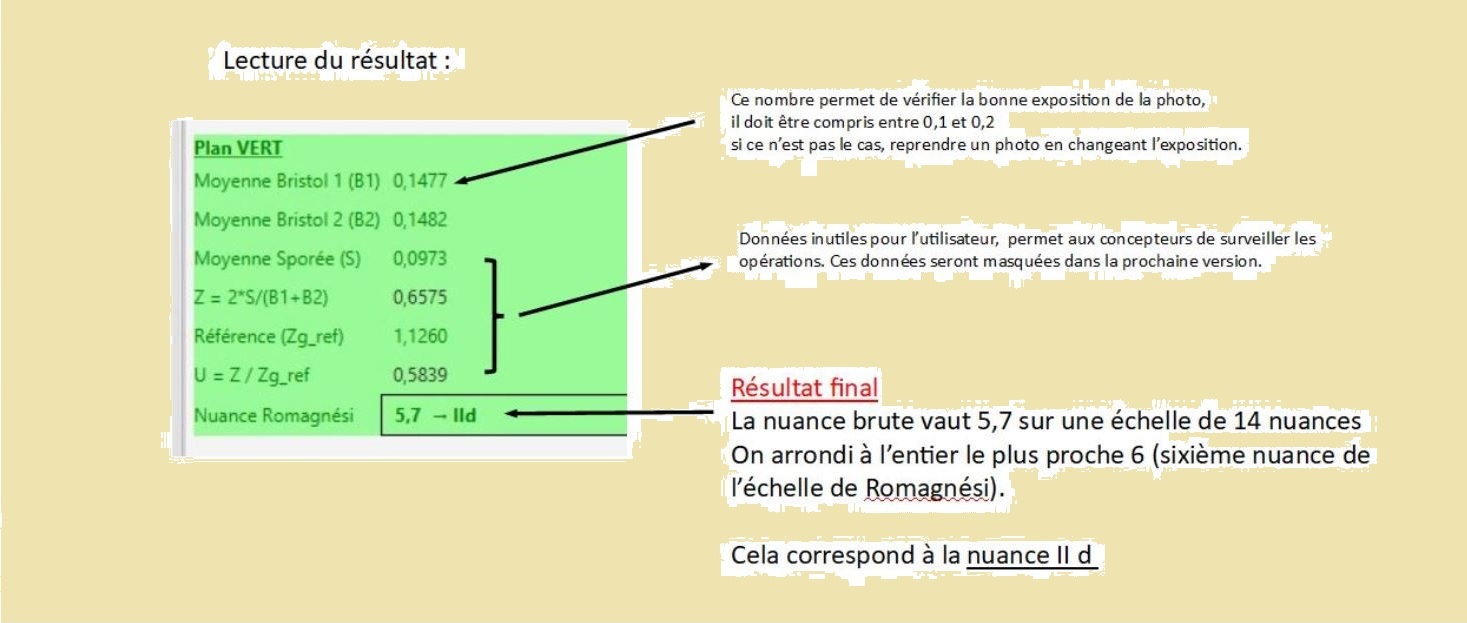
- Les deux zones blanches carrées de 1cm² sont les références de blanc nécessaires à la mesure avec le logiciel Ocre.
- Zoom sur la sporée
- Le format Raw de votre appareil photo doit être transformé en format universel .dng en utlisant par exemple Adobe DNG Converter.
Ouvrir le logiciel « Ocre » de Michel Corneloup téléchargeable sur le site.
Note :
Comme le logiciel fait la
moyenne de la luminance
dans le rectangle, veillez à
placer celui-ci sur des zones
bien uniformes.
Ouvrir la photo .dng.
Placer les rectangles blanc sur les deux pastilles de bristol.
Placer le rectangle jaune sur la sporée.
 Observation des spores au microscope :
Observation des spores au microscope :
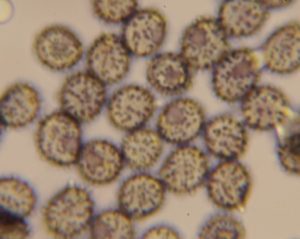
Les spores sont à verrues isolées ou faiblement connectées.
Une mesure avec l’oculaire micrométrique du microscope donne une longueur de 9 µm.

L’utlisation du Logiciel Rus_50
permet de faire un premier tri
des russules ressemblantes.
On remplit les cases avec les informations recueillies.

Résultat de la recherche avec Rus_50 :
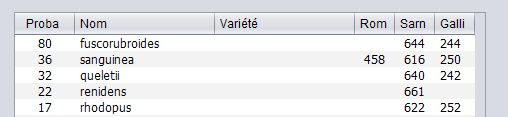
Seules les premières russules de la liste sont à considérer, car la correspondance avec la table de données devient faible.
Les pages des ouvrages de H. Romagnési (Rom), de M. Sarnari (Sarn) et R. Galli sont indiquées pour plus de commodité.
– Mauro Sarnari : « Monograia illustrada del Genere Russula in Europa », AMB 2007
– Roberto Galli : « Le Russule », Edinatura 1996
– Henri Romagnési « Les russules d’Europe » 1967, épuisé.

Russula fuscorubroides (Doubs – France)
Photo Jean-Marc Moingeon – Pharmanatur
Discussion :
La liste fournie par le logiciel Rus_50 nous dirige dans la section Sardoninae, des russules acres à pied colorés.
J’élimine R. rhodopus qui est plus rouge et brillante,
j’élimine R. sanguinea qui a une couleur typique rouge sang,
j’élimine R. renidens qui est une russule nordique du bouleau
Il reste R. queletii et R. fuscorubroides qui sont deux russules voisines, la seconde pouvant être une variété écologique de la première selon Romagnési. Je me reporte à la description de ces deux taxons par Marcel Bon, créateur de la seconde espèce en 1976 (Documents mycologiques Tome XVIII Fasc. 70, mars 1988). Il note, pour Russula fuscorubroides, un pied rouge carmin vif, des spores à verrues plus reliées que pour R. queletii, et un habitat sur sol plus acide et montagneux.
Notre spécimen provenant de la Salvetat-sur-Agout (32) , dans un bois d’épicéas sur sol granitique
(legs Claude Lecot) à 1000m d’alttude, je l’atribue à l’espèce Russula fuscorubroides.
Matériel nécessaire
– Appareil photo équipé du mode « Raw »
– Trépied pour le fixer
– Plaque de carton peint en noir pour le fond
– Bristol peint en noir , avec une ouverture de 1 cm² et deux zones blanches de 1 cm²
– Lame de rasoir
– 2 lames de microscope
– Ampoule LED verte ( j’utlise Ampoule Xanlite MG18V, 1W green)
– Microscope si on veut observer les spores
– Logiciels gratuits :
Adobe DNG Converter, pour transformer la photo en .dng,
Ocre, pour obtenir la nuance de la sporée,
Rus_50, pour trier les russules
Ces deux derniers téléchargeables sur le site de la S2HNH
Et de la patience