Atelier de mycologie du 5 février 2016, conduit par Marie-Jo Mauruc
1 – Prendre conscience de son environnement
Renseignements généraux :
– date de récolte, localité, lieux-dits, expositions(Nord, Sud, Sud-Ouest), altitude, points GPS
– nombres de photos in « situ », penser à mettre 1 étalon (feuille) pour pouvoir évaluer la taille.
– si possible donner un numéro d’échantillon : ex. MJM.201601280-2
– Récolteurs et Identificateurs
Écologie :
Habitat : Forêts, chemins, prairies, bord de route, champs cultivés, landes, jardins
Arbres ou plantes immédiatement voisins : Epicéa, Ciste, Pins, Saules etc.
Substrat : à terre, sur mousse, sur écorce d’arbres morts ou vivants, crottins etc.
Mode de groupement : isolés, en touffes, en cercle
Autres mesures : température du sol, composition du sol, humidité du substrat.
2 – Étude macroscopique (Description)
Sa forme globale : chapeau ou non, pied central ou non (Forme classique ou non)
Le chapeau : taille, forme, couleur, changements de couleur (« hygrophane » ou non) aspect de la surface (« cuticule »), aspect des bords du chapeau
Partie fertile : « hyménium »: lames, plis, pointes, tubes, insertion des lames,
Le pied (« Stipe ») : taille, forme, séparabilité, consistance, aspect en coupe, ornementations ou non, anneau et volve
Si possible faire une description et parfois un dessin, en notant les mesures et les particularités observées. Voir la fiche de description ; au début de chaque livre, quelques pages vous permettent de décrire assez précisément le champignon étudié.
Réactions macrochimiques :
Réactifs, partie testée, résultat ; parfois utiles (Russules, Agaric, Cortinaires parfois Amanites),à faire sur le terrain ou sur échantillon frais : sulfate de fer, potasse, phénol , Gaiacol etc.
3 – Études microscopiques des champignons
1- Milieux d’observation
a- L’eau : elle permet de mieux voir les pigments (cuticule) et certains éléments cellulaires ; la couleur des spores
b- La Potasse (5%) permet de solubiliser (Polypores ou pyrénomycètes) ou de colorer certains éléments particuliers
c- Le Rouge Congo : colore tous les éléments cellulaires (il contient de l’ammoniaque qui gonfle un peu les tissus mycéliens)
d- Le Bleu Coton ou bleu lactique : facilite l’observation des différents éléments ; chauffé il permet de différencier les champignons parasites par rapport au végétal de l’hôte ; il colore mieux les ornementations de la paroi sporale ; Chez les Lyophyllum les spores sont dites « cyanophiles ». (Cyan = bleu)
e- Réactif de Mezler : l’iode du réactif colore l’amidon des spores en bleu ou en noir soit au niveau de la paroi soit au niveau des ornementations
Mais aussi il peut colorer certaines parties du tissu mycélien (Mycènes); C’est un test important chez les Ascomycètes.
On parle de – spores « amyloides » : ex. Amanita ovoidea, A phalloide, A. spissa
– spores non « amyloides » : ex. Amanita junquillea, A.caesarea
2- Les spores de champignon
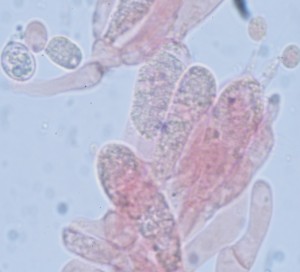
Basides et basidiospores
Les spores sont des organes de dissémination chez les champignons (sortes de graines ou pollen)
Elles ont donc des parois plus ou moins fines ou épaisses qui leur donnent à maturité une forme rigide.
L’étude des spores ne permet pas d’identifier à elle seule une espèce, mais permet par une observation rapide d’orienter plus ou moins vers un genre : Entolome par exemple. ;
Elles sont produites par les basides —Basidiomycètes
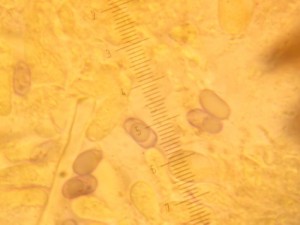
dans des asques— Ascomycètes
Pour étudier les spores on doit observer :
Asque et ascospores
1- leur couleur (« sporée » et étude au microscope)
2- Leur forme
3- Leur taille
4- Leurs ornementations
Pour que l’étude des spores soit plus précise (Taille, couleur, ornementations) elles doivent être « mûres »
Donc il faut récolter celles qui sont tombées sur le haut du pied ou à partir d’une sporée.
La « sporée » est un amas des spores recueillies sur lames de verre ou sur un morceau de bristol noir ou blanc .Elle permet d’observer la couleur des spores.
Comment réaliser une « sporée » ?
1) sur bristol sur un verre avec de l’eau
2) directement sur deux lames de verre sur un verre avec de l’eau
3) directement sur une lame de verre dans une boîte fermée avec un coton imbibé d’eau pour les petits échantillons
Dans tous les cas on doit maintenir une certaine humidité (1 heure à parfois 24heures)
Nota Bene :.on peut également prélever un petit bout de la lame (ou de tube) du champignon, et faire un montage au microscope .Dans ce cas la coloration des spores est visible mais moins nette.
Préparations et milieux d’observations
1- L’eau : pour bien voir si les spores sont colorées ou non il faut faire un montage dans l’eau ; ce montage permet aussi des mesures correctes
2- Le Rouge Congo : Colore tous les éléments cellulaires (il contient de l’ammoniaque), mais aussi les spores la couleur des spores est alors plus difficile a évaluer surtout pour les colorations claires Hébélomes, Plutée .
3- Le Bleu Coton ou bleu lactique : permet aussi de voir les différents éléments mais il colore mieux les ornementations de la paroi sporale ; Chez les Lyophyllum les spores sont dites « cyanophiles ». (Cyan =bleu)
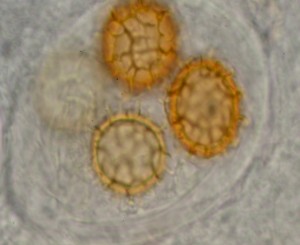
Spores amyloïdes
4- Réactif de Mezler : l’iode du réactif colore l’amidon des spores en bleu ou en noir soit au niveau de la paroi soit au niveau des ornementations
On parle de spores – « amyloides » : ex. Amanita ovoidea, A phalloide, A. spissa
spores non « amyloides » :ex : Amanita junquillea, A.caesarea
Étude macro et microscopique des spores
a)- Couleur des spores
– Blanche ou « hyaline » (Amanita, Tricholoma, Cantharellus, Clitocybe, Laccaria )
– Rose ou brique : Plutée, Clitopilus prunulus (le meunier), Entolomes, Crepidotus
– Beiges à marron ; Hébélomes, Cortinaires, Pholiota
– Noires : Coprins, Gomphidius.
– Jaune plus ou moins soutenu : Russula
b)- Structure et formes des spores
– Structure :
Les spores possèdent un- « apicule » par lequel elles sont fixées à la baside
– parfois un « pore germinatif » bien visible (zone de germination de la spore) :
ex. Coprinus, Psathyrella, Strophaire.
– dans certain cas une « zone supra-apiculaire » plus ou moins nette (ex.Galerina)
– Formes des spores :
Les spores peuvent être
– sphériques ex : Rhizopogon, Tulostoma, Laccaria, Lactaires et Russules
– ellipsoïdes : ex. Amanita (certaines), Pluteus, Volvaires.
– cylindriques : ex. Boletus , Gomphidius.
– Anguleuses : ex. Entoloma, Inocybe.
– Polygonales : ex. Clitopilus, Rhodocybe, Entoloma.
c)- Mesures des spores
Pour mesurer les spores, mettre la préparation à l’objectif 100, choisir les spores placées de profil sous le microscope ; on doit voir l’apicule nettement. A l’aide du micromètre oculaire mesurez la longueur (x divisions) et mesurez la plus grande largeur (y), Donnez la mesure en µ.(micron 1/1000 mm)
Pour avoir une évaluation correcte il faut faire plusieurs mesures (10 à 20) et faire une moyenne
Exemple de mesure : Xerocomus badius : 11, 4-16,2 x 4-6,3 µm. ; Q=L/l =2,1-3,3 ; Parfois des valeurs extrêmes sont données entre parenthèses.
d)- Ornementations des spores
L’ornementation des spores s’observe mieux avec le bleu lactique ou avec le Réactif de Mezler.
La plupart des Gastéromycètes ont des spores brunes ornées de petits piquants ou de petites verrues
Les Laccaria ont des spores plus ou moins sphériques,hyalines et avec des piquants plus ou moins longs.
Les Russules et les Lactaires ont des spores rondes, ornées de verrues, ponctuations, réseau ou même des crêtes.
Les Hébélomes et Cortinaires ont des spores ovales plus ou moins en forme de citron ponctuées plus ou moins grossièrement.
3- Étude microscopique des autres éléments
a) le chapeau : étude de la cuticule on peut observer
– sa structure (éléments cellulaires sphériques ou filamenteux)
– la présence de poils ou de « pileocystides » ex.Russula
– des boucles
– les pigments (vacuolaires, membranaires, pariétal
intercellulaires ou cytoplasmique)
-d’autres éléments particuliers : restes de voiles : Coprins
Pour cette étude il faut faire un « scalp » ou une coupe entre deux lames de rasoirs et observer dans l’eau (pigments) ou dans le Rouge Congo
b) Au niveau de « l’hyménium » :
Avec une préparation au Rouge Congo mais aussi dans l’eau ou le bleu lactique on peut observer : Sur une coupe fine transverse, la « trame » des lames
Sur une coupe tangentielle
– Les « basides » :- – Leur structure (Hétérobasides (Tremella, Auricularia ) et baside non divisée (Homobasides : Pluteus ,Russules, Etc…)
– leur forme, leur taille
– si elles sont bipolaires (2 spores) ou tétrapolaires(4 spores), parfois 6 ou 8 spores
– La présence de boucle à la base
– Les « cystides » : – « Cheylocystides » situées sur l’arête des lames
-« Pleurocystides » situées sur les faces des lames
Ces cystides ne sont pas présentes(ou remarquables) chez tous les champignons mais elles peuvent être caractéristiques dans certains groupes : Inocybes, Galerina, Conocybe, Stropharia etc. et doivent être étudiées et mesurées.
c) Au niveau du stipe
Avec un scalp et le Rouge Congo on peut observer
– les « caulocystides » (juste sous les lames ou parfois au bas du pied ) Ex Inocybes
– La structure de l’anneau.
– La structure de la volve
Marie-Jo Mauruc